Numerosi episodi di intossicazione
in diverse specie di animali da reddito o di affezione sono stati causati
dal contatto più o meno prolungato degli stessi con strutture (stalle,
cucce, grigliati) realizzate con legno impregnato da PCP (pentaclorofenolo)
inquinato da diossine. L'uso di PCP per questo tipo di trattamento è
attualmente proibito, ma sono ancora presenti grandi quantità di
legname trattato. Le diossine contenute nel legname vengono progressivamente
rilasciate nell'aria dell'ambiente. Gli animali che vivono in locali contaminati
assumono diossine sia per via respiratoria che per contatto diretto con
le strutture in legno. Il ruolo dei pentaclorofenoli come fonte di diossine
aumenta proporzionalmente con il passare del tempo, perchè, a differenza
di altre fonti, essi vengono raramente individuati e controllati: nella
tabella 1,
| Processo |
|
|
| Incenerimento di rifiuti urbani: |
|
|
| Processi di sinterizzazione: |
|
|
| Emissioni da PCP usato in passato: |
|
|
| Incenerimento di rifiuti chimici: |
|
|
| Incenerimento di legname: |
|
|
| Traffico: |
|
|
| Industria metallurgica: |
|
|
| Combustione di carbone e lignite: |
|
|
| Processi ad alta temperatura (vetro): |
|
|
| Incenerimento di rifiuti ospedalieri: |
|
|
| Eliminazione di cavi e motori: |
|
|
| Combustione di olii residui: |
|
|
| Processi di produzione chimica: |
|
|
| Incenerimento di biogas e fanghi: |
|
|
| Mescolatura asfalto: |
|
|
| Cremazione: |
|
|
| Totale: |
|
|
Tossicità
Fra tutte le diossine
ed i dibenzofurani esistenti, i composti di rilevante interesse tossicologico
possiedono le seguenti caratteristiche:
Caratteristiche
tossicocinetiche
Per comprendere il potenziale
tossico della diossina è indispensabile analizzare gli aspetti tossicocinetici
di questa sostanza, in quanto le vie di assunzione, metaboliche e di accumulo,
portano a manifestazioni differenti.
Assorbimento
e distribuzione tissutale
L’ assorbimento enterico
della TCDD è molto elevato; si calcola una percentuale superiore
all’80% per animali adulti, ammesso che la diossina venga assunta in forma
libera disponibile (Poiger & Schlatter, 1980).
La percentuale di assorbimento è inferiore per le diossine maggiormente
alogenate. Di conseguenza, la composizione della miscela di diossine assorbita
potrebbe essere molto diversa da quella di esposizione, con le frazioni
tetra- e penta-clorate più facilmente trattenute. Le diossine si
accumulano nel tessuto adiposo e nel fegato, in proporzioni variabili a
seconda della dose e della specie animale coinvolta (tabella 6).
| Specie | Dose (ng/kg p.v.) | Concentrazione (ppt) | |
| Fegato | Tess. adiposo | ||
| uistiti | 100 | 900 | 1000 |
| ratto | 100 | 700 | 600 |
| ratto | 10 | 40 | 50 |
| ratto | 1 | 3 | <5 |
| uomo | 1 | - | 3 |
Eliminazione
e persistenza
Tutte le diossine diverse
dalle tetracloro-sostituite vengono rapidamente eliminate dall’organismo
dei mammiferi attraverso due differenti meccanismi: nel primo caso le diossine
vengono convertite nel fegato in composti dalle caratteristiche maggiormente
polari, che vengono poi escreti per via biliare (Poiger
et al., 1982). Il secondo meccanismo è rappresentato dalla escrezione
diretta attraverso la parete intestinale, specialmente per quanto riguarda
le diossine con un elevato numero di atomi di cloro (Abraham
et al., 1989).
Tossicocinetica
nelle esposizioni croniche
Nel caso di esposizioni
protratte a dosi molto basse, la concentrazione di TCDD tende ad assumere
un valore costante di equilibrio, con valori differenti da specie a specie,
a causa dei differenti tempi di dimezzamento: ad esempio si può
passare dalle 3 settimane del ratto (Rose et al.,
1979) ai sette anni dell’uomo (Poiger &
Schlatter, 1986). In tali condizioni, ad esempio, una assunzione giornaliera
di soli 10 pg/kg p.v. porterà nell’uomo allo stesso livello di accumulo
raggiugibile nel ratto con una dose di 1 ng/kg p.v./giorno.
Tossicità
acuta
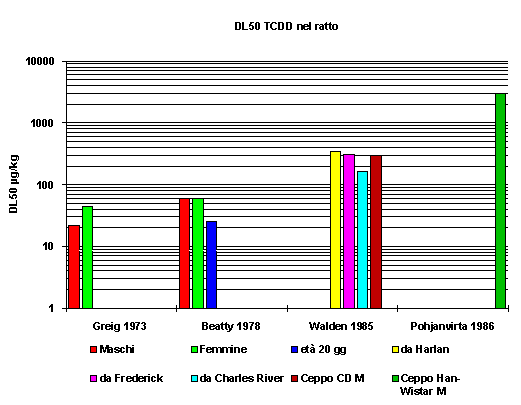
La dose in grado di indurre
la morte è molto variabile da specie a specie, ma anche all’interno
della stessa specie animale a seconda del sesso e del ceppo, nonché
dell’età e della via di somministrazione. La DL50 nella cavia maschio,
la specie più sensibile, è 8000 volte minore di quella del
criceto dorato. Il ratto sembra la seconda specie più sensibile,
anche se la DL50 può variare di circa 200 volte tra ceppi differenti
(figura 8).

Anche nel topo si assiste a una tale variabilità, anche tra ceppi uguali ma provenienti da allevatori differenti (Walden & Schiller, 1985). La causa di questo fenomeno risiede probabilmente nella variabilità genetica riguardo al recettore AHR (vedi “Meccanismo d’azione”). Per quanto riguarda la differente sensibilità tra i sessi, la maggior parte dei lavori su topi, ratti e criceti riporta dati in contraddizione tra loro (Schvetz et al., 1973; Beatty et al., 1978; Smith et al., 1981; Mc Connel et al., 1978; Silkworth et al., 1982; Olson et al., 1980).
Cancerogenesi
La TCDD possiede un elevato
potenziale cancerogeno in alcuni animali: i dati disponibili dimostrano
la sua capacità di agente promovente in grado di indurre la trasformazione
neoplastica di cellule epatiche se assunta dopo l’esposizione a dosi sub-carcinogenetiche
di altri agenti cancerogeni (Holder & Menzel,
1989). A conferma della complessità dei meccanismi di interazione
biologica della diossina, è evidente anche una azione “anticancerogena”
di questa molecola, la cui assunzione porta alla diminuzione della insorgenza
di alcuni tipi di tumore (ipofisi, pancreas, tiroide, utero, ghiandole
mammarie, surrene), nelle stesse specie (ratti) in cui, alle stesse dosi,
provoca neoplasie al palato duro, ai turbinati, alla lingua, al fegato
e al polmone (Kociba et al., 1978). Per di
più la diossina pare caratterizzata da una soglia ben precisa, al
di sotto della quale non si osserva alcun effetto oncogeno: nel ratto,
in ceppi diversi e con diversi protocolli di somministrazione, l’azione
cancerogena si osserva solo con dosi di oltre 10 ng/kg p.v./die (Kociba
et al., 1978; NTP, 1982; Pitot
et al., 1987). Il tumore indotto nel polmone è un carcinoma
a cellule squamose, peraltro molto raro nel ratto. Allo stesso modo, anche
i carcinomi alla lingua ed al palato duro raramente insorgono in modo spontaneo.
La tabella 2
riassume i dati dei test di cancerogenicità delle PCDD somministrate
per via orale in animali da laboratorio.
|
|
|
|
|
| 2,3,7,8-TCDD(Van Miller et al., 1977) | Orale (dieta) 0.0, 0.001, 0.005, 0.05, 0.5, 1.0, 5.0 mg/kg 78/95 settimane | Ratto/Sprague-Dawley/M | per tutti i tumori: 0/10 a 0.0, 0/10 a 0.001, 5/10 a 0.005, 3/10 a 0.05, 4/10 a 0.5, 4/10 a 1.0, 7/10 a 5.0 mg/kg |
| 2,3,7,8-TCDD(Kociba et al., 1978) | Orale (dieta) 0.0, 0.001, 0.01, 0.1 mg/kg/die 105/105 settimane | Ratto/Sprague-Dawley/M | carcinoma a cellule squamose del palato duro: 4/50 a 0.1 mg/kg/die; carcinoma a cellule squamose della lingua 1/50 a 0.001 e 0.01, 3/50 a 0.1 mg/kg; adenoma della corticale surrenale 2/5 a 0.01 e 5/50 a 0.1 |
| Ratto/Sprague-Dawley/F | carcinoma epatocellulare 0/86 a 0.0, 0/50 a 0.001, 2/50 a 0.01, 11/49 a 0.1; carcinoma a cellule squamose della lingua 1/50 a 0.01, 4/49 a 0.1, carcinoma a cellule squamose del polmone 7/49 a 0.1 | ||
| 2,3,7,8-TCDD (NIH, 1982a) | Orale (olio di mais/acetone 9/1) 0.0, 0.1, 0.05, 0.5 mg/kg alla settimana104/105-107 sett. | Ratto/Osborne-Mendel/M | carcinoma della tiroide 1/69 a 0.0, 5/48 a 0.1, 8/50 a 0.05, e 11/50 a 0.5 mg/kg/settimana |
| Ratto/Osborne-Mendel/F | carcinoma della tiroide 3/73 a 0.0, 2/45 a 0.1, 1/49 a 0.05, 6/47 a 0.5; carcinoma epatocellulare 5/75 a 0.0, 1/49 a 0.1, 3/50 a 0.05, 14/49 a 0.5 mg/kg/settimana | ||
| 2,3,7,8-TCDD(NIH, 1982a) | Orale (olio di mais/acetone 9/1) Maschi 0.0, 0.01, 0.05, 0.5 mg/kg alla settimanaFemmine 0.0, 0.04, 0.2, 2 mg/kg alla settimana104/105 settimane | Topi/B6C3F18/M | Carcinoma epatocellulare 8/73 a 0.0, 9/49 a 0.01, 8/49 a 0.05, 17/50 a 0.5 mg/kg alla settimana |
| Topi/B6C3F18/F | Carcinoma epatocellulare 1/73 a 0.0, 2/50 a 0.04, 2/48 a 0.2, 6/47 a 2.0adenoma delle cellule follicolari della tiroide 0/69 a 0.0, 3/50 a 0.04, 1/47 a 0.2, 5/46 a 2.0 mg/kg alla settimana | ||
| 1,2,3,6,7,8,/1,2,3,7,8,9-HEXACDD (1/2)(NIH, 1980b) | Orale (olio di mais/acetone 9/1), 0.0, 1.25, 2.5, 5.0, mg/kg alla settimana104/105 settimane | Ratto/Osborne-Mendel/M | Noduli neoplastici al fegato o carcinoma epatocellulare 0/74 a 0.0, 10/50 a 1.25, 1/50 a 2.5, 4/48 a 5.0, mg/kg alla settimana |
| Ratto/Osborne-Mendel/F | Noduli neoplastici al fegato o carcinoma epatocellulare 5/75 a 0.0, 10/50 a 1.25, 12/50 a 2.5, 30/50 a 5.0, mg/kg alla settimana | ||
| 1,2,3,6,7,8,/1,2,3,7,8,9-HEXACDD (1/2)(NIH, 1980b) | Orale (olio di mais/acetone 9/1), Maschi 0.0, 1.25, 2.5, 5.0, mg/kg alla settimanaFemmine 0.0, 2.5, 5.0, 10.0 mg/kg alla settimana104/105-108 settimane | Topi/B6C3F18/M | adenomi epatocellulari o carcinomi: 15/73 a 0.0, 14/50 a 1.25, 14/49 a 2.5, 24/48 a 5.0 mg/kg alla settimana |
| Topi/B6C3F18/F | adenomi epatocellulari o carcinomi: 3/73 a 0.0, 4/48 a 2.5, 6/47 a 5.0, 10/47 a 10.0 mg/kg alla settimana |
le diossine rivestono un ruolo di primo piano (U.S. EPA, 1994). Esse possono determinare effetti a volte anti-estrogenici, a volte simil-estrogenici a seconda del tessuto o dell’organo interessato, attraverso il legame con il recettore non-ormonale AHR. Negli animali da laboratorio, l’esposizione a basse dosi di TCDD è in grado di inibire gli effetti degli estrogeni a livello di ghiandola mammaria, mentre dosi più sostenute durante la gravidanza inducono effetti demascolinizzanti nella prole maschile, con modalità simili a quanto osservato somministrando estrogeni sintetici (U.S. EPA, 1994; Safe, 1995). La TCDD sembra ridurre l’incidenza delle neoplasie dell’utero e della ghiandola mammaria sia nella specie umana che negli animali, probabilmente interferendo con l’azione di altre sostanze ad azione estrogenica di origine sia endogena che esogena (medicinali, fitoestrogeni, ecc.). Una singola dose di 64 ng/kg p.v. somministrata a femmine di ratto in gravidanza, è in grado di indurre effetti sulla morfostruttura di testicoli e prostata nella progenie maschile, con successiva riduzione funzionale che si evidenzia nella conta degli spermatozoi (Mably et al., 1991 - 1992). Le lesioni intervengono solo somministrando la TCDD in un determinato giorno della gravidanza, corrispondente alla differenziazione dell’apparato sessuale maschile. La TCDD possiede una notevole attività perturbante nei confronti della tiroide, specialmente in animali giovani: l’induzione enzimatica a livello epatico da essa determinata sembra portare ad una prematura degradazione dell’ormone tiroideo T4, con conseguente iperstimolazione della tiroide da parte dell’ipofisi, fino alle estreme conseguenze dell’induzione neoplastica.