La diossina può
danneggiare il sistema immunitario in modo diretto ed indiretto: numerosi
studi condotti su topi, ratti, porcellini d’India, conigli, bovini, scimmie,
esseri umani, evidenziano alterazioni a carico del sistema immunitario
indotte da diossine anche a dosi molto limitate (U.S.
E.P.A., 1994). La diossina sembra ridurre direttamente la popolazione
di linfociti B, mentre i linfociti T verrebbero danneggiati indirettamente
attraverso effetti indotti sul sistema endocrino: la diossina è
in grado di interferire con l’azione di glucocorticoidi, ormoni sessuali,
tiroxina, ormone della crescita e prolattina (U.S.
E.P.A., 1994). L’azione della diossina può essere particolarmente
invalidante durante lo sviluppo fetale, al momento della differenziazione
tissutale del sistema immunitario, determinando alterazioni a lungo termine,
sia in senso immunodepressivo che ipersensibilizzante. Piccole variazioni
nella dose e nel momento di esposizione possono causare effetti molto diversi
negli animali, dalla maggiore vulnerabilità agli agenti infettivi
alla induzione di fenomeni autoimmunitari ed allergie. Non è stato
possibile evidenziare una soglia al di sotto della quale la diossina perda
la propria immunotossicità: anche dosaggi al limite della sensibilità
strumentale sembrano in grado di alterare la funzionalità immunitaria.
Nel topo una singola somministrazione pari a 10 ng/kg p.v. causa un evidente
aumento della mortalità in seguito ad esposizione al virus dell’influenza
(Burleson, 1994). Il timo è uno degli
organi più sensibili in assoluto all’azione della diossina: benchè
esistano differenze di specie, il tessuto linfoide rappresenta un bersaglio
molto sensibile in tutti gli animali studiati. La TCDD danneggia tanto
l’immunità umorale che l’immunità cellulo-mediata. Anche
il sistema del complemento è influenzato dall’esposizione alla diossina
(White et al., 1986). Gli effetti sul timo e sulla immunità cellulo-mediata
appaiono particolarmente specifici, in quanto insorgono a livelli di esposizione
inferiori a quelli necessari per qualsiasi altra funzione immunitaria.
Le lesioni al timo sono dirette, a carico dei timociti immaturi (linfociti
della corticale), la cui evoluzione a linfociti T immunocompetenti viene
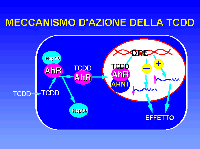
bloccata. Il recettore AHR è particolarmente abbondante nelle cellule
epiteliali della corticale, fatto che sembra giustificare la particolare
sensibilità del timo alla diossina.
L’immunità umorale
viene alterata attraverso una riduzione quantitativa delle immunoglubuline
, anche a livelli di TCDD talmente bassi da non determinare alcun altro
effetto.
L’azione tossica della
TCDD nei vari tessuti delle varie specie animali è mediata dall’azione
del recettore cellulare AHR (Aryl Hydrocarbon Receptor), una proteina solubile
intracellulare in grado di legarsi a numerose sostanze aromatiche, alogenate
e non (figura 10). Gli atomi di cloro nelle quattro posizioni laterali,
caratteristici della TCDD, conferiscono alla molecola la massima affinità
con il recettore e, di conseguenza, la massima tossicità. L’affinità
diminuisce al diminuire dei sostituenti Cl laterali e all’aumentare del
numero totale dei sostituenti Cl. Il recettore AHR ( indicato anche come
Ah) possiede caratteristiche biochimiche affini ai recettori per gli ormoni
steroidi, anche se per ora non è stata individuata una molecola
endogena specifica che vi corrisponda: la sua struttura è comunque
molto simile a quella dei recettori per i glucocorticoidi. Allo stato libero
è reperibile sia nel citosol che nel nucleo, apparentemente in condizioni
di equilibrio (Denison et al., 1986a,c), complessato con almeno 3 proteine
addizionali (Perdew, 1992). La diossina, che si trova nei tessuti allo
stato libero, diffonde liberamente all’interno delle cellule (fig. 10),
dove incontra il recettore ARH.

L’insieme TCDD/ARH subisce
una serie di trasformazioni non ancora ben chiarite, ma che comportano
il rilascio di hsp90 (“heath shock protein” da 90 kDa) e di altre proteine.
Il complesso TCDD/ARH, attraverso queste trasformazioni, acquista la capacità
di legarsi ad una proteina nucleare, chiamata ARNT (Ah Receptor Nuclear
Translocator) (Dolwick, 1993; Hoffman,
1991). Il complesso che si viene a formare possiede una elevata affinità
per alcune sequenze di DNA, le DRE (Dioxin Responsive Elements), situate
nelle adiacenze del gene CYP1A1 che regola la sintesi del citocromo microsomale
P-450 e l’attività della correlata monossigenasi AHH (Aryl Hydrocarbon
Hydroxylase) (Withlock, 1990). I dati disponibili
sembrano evidenziare altre attività del complesso TCDD-AHR, sui
meccanismi di differenziazione e divisione cellulare, sulle interazioni
con fattori di crescita, sul metabolismo di alcuni ormoni (es. aumento
della deplezione epatica dell’ormone tiroideo T4 attraverso l’induzione
dell’enzima UGT (UDP- glucuronosiltransferasi): l’insieme di queste azioni
porta al manifestarsi di conseguenze assai diverse a seconda della specie
animale, della razza, del sesso e dell’età del soggetto coinvolto,
nonché del tipo di cellula esposta all’azione del tossico. Tuttavia,
il complesso AHR-TCDD, da solo, assume unicamente il significato di elemento
necessario ma non sufficiente ai fini di spiegare tutti gli effetti tossici
delle diossine: infatti, spesso la disponibilità del recettore e
la conseguente formazione del complesso non determinano di per sé
tossicità. Elementi modulanti la risposta in animali e tessuti diversi
sono rappresentati dal polimorfismo dei siti cromatinici per il complesso
AHR-TCDD e dalla affinità dose dipendente di tali siti (Greig et
al., 1984). Negli animali esposti cronicamente a dosi subletali di TCDD
è possibile notare una marcata porfiria: le cause sembrano risiedere
in due diversi tipi di meccanismi indotti dalla diossina negli epatociti.
Il primo è rappresentato da un aumento dell’attività dell’acido
aminolevulinico (ALA) sintetasi (Goldstein et
al., 1973); il secondo consiste nella diminuzione dell’attività
della porfinogeno decarbossilasi (Poland &
Glover, 1973).
La TCDD appare coinvolta
anche nel meccanismo di accumulo della vitamina A: molti degli effetti
riscontrati negli animali in seguito all’esposizione a diossina sono sovrapponibili
a quelli tipici conseguenti ad una carenza di vitamina A nella dieta (ritardo
nell’accrescimento, cheratosi, lesioni epiteliali, immunosoppressione,
ipofertilità e problemi teratologici) (Thunberg
et al., 1980). In particolare, appaiono interessanti gli effetti sui
tessuti epiteliali riguardanti il processo di cheratinizzazione. La vitamina
A riveste un ruolo essenziale nei processi di differenziazione cellulare:
una carenza può indurre la trasformazione di un epitelio ghiandolare
in squamoso cheratinizzato, mentre il processo inverso può essere
determinato da un eccesso di vitamina (Wolf,
1980). A livello molecolare, il meccanismo d’azione della vitamina
A, nei tessuti epiteliali, consiste nel modulare la sintesi della cheratina,
attraverso il controllo del corrispondente mRNA (Fuchs
& Green, 1981). La TCDD è in grado di causare una forte
deplezione della riserva epatica di vitamina A, provocandone la rapida
escrezione nelle feci e nelle urine. Ciò sembra accadere soprattutto
a causa delle conseguenze degli effetti tossici della diossina sull’epatocita,
unitamente ad un effetto di interferenza sul meccanismo di accumulo della
vitamina (Olson & Gunning, 1983).
Il quadro anatomo-patologico presenta aspetti in comune in numerose specie animali, unitamente a tratti peculiari riscontrabili solo in alcune. In genere i reperti anatomo-patologici tipici dell'animale morto per intossicazione da diossine sono rappresentati da: 1) perdita pressochè totale del grasso corporeo; 2) aumento di peso e volume del fegato; 3) atrofia del timo. Nonostante i differenti effetti che PCDD e PCDF (pentaclorodibenzofurani) inducono nelle diverse specie, ma anche intra-specie, gli isomeri più tossici (ad esempio i sostituiti con Cl nelle posizioni 2,3,7 e 8) causano effetti sovrapponibili: il potenziale tossico degli isomeri sembra dipendere dall’idoneità più o meno spiccata ad unirsi con il recettore AHR. L’interazione del complesso isomero-recettore con il DNA cellulare induce l’espressione di geni diversi. A seconda del tipo cellulare coinvolto, si potranno avere conseguenze degenerative o proliferative (Poland & Knutson, 1982). In condizioni reali, gli animali possono essere esposti a miscele molto differenti di PCDD e PCDF, a concentrazioni diverse, per intervalli di tempo variabili ed attraverso vie di assunzione differenti: questi fatti, unitamente alle differenze nel metabolismo di queste sostanze nelle varie specie, porta ad un insieme di lesioni anatomo-patologiche complesso. Le osservazioni seguenti si riferiscono a lesioni ricontrate nei medesimi distretti in specie differenti, in occasione di autopsie eseguite in seguito ad episodi di intossicazione accidentale (per la maggior parte in relazione all’episodio di contaminazione di Times Beach nel 1971, del quale le tabelle 3 e 4 e le figure dalla 12 alla 19 mostrano i dati riassuntivi), oppure ad intossicazioni sperimentali.
Le lesioni epatiche riscontrabili nel ratto consistono in un rigonfiamento del reticolo endoplasmatico liscio e nell’aumento del contenuto lipidico degli epatociti. Sono inoltre presenti numerose cellule multinucleate per fusione del citoplasma. Nel pollo prevalgono invece steatosi e degenerazione ialina. Nel cavallo, nel gatto e nei piccoli ruminanti è possibile notare una evidente iperplasia dei dotti biliari, accompagnata da focolai di necrosi nelle zone centrolobulari, con una elevata quantità di cellule del Kupffer sature di emosiderina. Attorno alle vene centrolobulari è presente notevole fibrosi, che appare invece limitata alla periferia del lobulo, con un aspetto che ricorda le forme croniche veno-occlusive nell’uomo (Kimbrough R.D. et al., 1977). L’esame del tessuto epatico di bovini, polli, oche ed anatre muschiate, contaminati nell’episodio di Seveso, ha evidenziato nel citoplasma evidenti ammassi di reticolo endoplasmatico ruvido e liscio, con mitocondri rigonfi e granuli di emosiderina. I nuclei si presentavano con indentazioni e cisterna perinucleare leggermente dilatata (Pellegrini, 1982). L’esposizione cronica subletale alla TCDD provoca un accumulo di porfirine nel fegato ed un incremento dell’escrezione urinaria di queste sostanze. Nei casi conclamati, l’accumulo di porfirine si estende anche alla milza ed ai reni. Nel ratto una marcata porfiria è riscontrabile dopo 8 mesi di esposizione ad una dose di 1 mg/kg p.v. per settimana.
Lesioni renali e dell’apparato urinario
Reperti anatomo-patologici che coinvolgano reni ed apparato urinario sono stati descritti solo in occasione di avvelenamento da diossine, con esito letale, in cavalli da maneggio e gatti domestici (Kimbrough et al., 1977). Nel gatto sono stati reperiti cambiamenti degenerativi, specialmente a carico dell’epitelio dei tubuli; in un caso è stato possibile riscontrare anche fibrosi e focolai flogistici nell’interstizio. I cavalli, tutti Quarter Horses, mostravano un quadro di nefrite interstiziale acuta, con segni di degenerazione a carico dell’apitelio tubulare e dilatazione dei glomeruli, nonchè una disseminazione di microascessi.