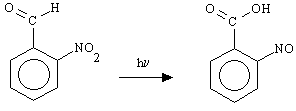
| 1.3 | Strumentazione |
Ai fini dello svolgimento di esperimenti di flash fotolisi è
necessario un apparato strumentale in grado di produrre un flash luminoso che possegga tre
caratteristiche fondamentali: una lunghezza d'onda adeguata; una energia tale da
fotolisare una quantità sufficiente di caged; una durata sensibilmente inferiore rispetto
ai tempi dei fenomeni oggetto d'indagine.
Le lunghezze d'onda utili ai fini fotolitici per i composti usati cadono nell'intervallo
300-360 nm. Il valore al quale si ha un massimo di efficacia varia, all'interno di questo
intervallo, per i diversi composti.
Per quanto riguarda le energie emesse si può considerare come dato orientativo che con un
flash di 20 mJ a 347 nm si può ottenere ATP 2 mM da caged ATP 5 mM [57]. Per uno stesso
caged compounds e una stessa sorgente per la fotolisi la quantità di effettore rilasciata
cresce proporzionalmente all'energia del flash. Tale energia non è però quella in uscita
dallo strumento, ma quella porzione che, dopo essere stata filtrata e focalizzata, incide
sulla superficie del campione. Oltre alla sorgente luminosa ha quindi importanza la parte
ottica della strumentazione che deve filtrare opportunamente il raggio di luce e
focalizzarlo (vengono usate lenti al quarzo) senza diminuirne significativamente l'energia
alle lunghezze d'onda utili. Naturalmente, mantenendo costante la parte ottica e la
geometria del campione, variazioni dell'energia in uscita producono variazioni
proporzionali nella concentrazione dell'effettore. Con la stessa sorgente e lo stesso
caged compound sono state ottenute rese che variano da circa l'1% [29] al 77% [26].
In relazione ai tempi dell'impulso luminoso è necessario fare alcune considerazioni.
L'effettiva sincronizzazione dei processi che si vanno a studiare dipende in prima istanza
dalla durata del flash necessaria a produrre una sufficiente quantità di effettore.
Impulsi più brevi consentono un maggior grado di simultaneità nell' innesco dei
processi. D'altra parte la maggior durata del flash può determinare, a parità di energia
emessa, una maggiore resa fotolitica in quanto, nell'intervallo di tempo durante il quale
sono illuminate, le molecole del composto fotosensibile possono sottostare a più cicli di
eccitazione.
La sorgente luminosa può essere costituita da lampade o laser [57]. Tra questi ultimi
quello maggiormente impiegato è il laser a rubino. L'impulso emesso viene limitato a
circa 50 ns mediante un otturatore Q. Il raggio primario è polarizzato e ha una lunghezza
d'onda uguale a 694 nm; dal passaggio di questo attraverso un cristallo duplicatore di
frequenza si ottiene un raggio secondario polarizzato perpendicolarmente a quello primario
e con l = 347 nm. Completa l'apparato un filtro od altro
sistema per separare i due raggi. Con il laser a rubino si possono ottenere energie del
raggio secondario fino a 300 mJ.
Il laser a neodimio-YAG a frequenza triplicata è un altro laser a stato solido impiegato
nella flash fotolisi. L'impulso finale che si ottiene ha l = 355 nm
e porta un energia di 15-25 mJ in un tempo variabile da meno di 10 a 30 ns.
I laser a colorante, utilizzabili duplicando la frequenza del raggio primario, producono
generalmente impulsi di maggior durata. Con alcuni di questi sistemi si sono ottenuti
flash con le seguenti caratteristiche: l = 340 nm,
energie di 30 mJ in tempi di 5 ms [63]; l
= 352 nm, energie di 0.6 mJ in 600 ns [60]; >l = 320 nm,
energie di 20-60 mJ in 1 ms [98].
Un'ultima categoria di laser, quelli a semiconduttore, produce impulsi molto brevi, anche
inferiori ai 10 ns [96] con energie che possono abbondantemente superare i 100 mJ. Tra
questi quello a XeCl emette a l = 308 nm,
mentre quello XeF a l = 351 nm [59].
E' possibile effettuare esperimenti di flash fotolisi con lampade (a Hg o a Xe) ad
emissione continua attrezzate con un otturatore [76, 92], in questi casi sono però
richiesti tempi di flash nell'ordine dei secondi che ne compromettono l'uso in studi di
tipo cinetico. Più adeguate sono alcune lampade a flash [71, 78] e in particolare un
sistema messo a punto negli ultimi anni in grado di produrre un impulso in uscita di
100-200 mJ in tempi anche inferiori ad 1 ms [77]. Questo dispositivo si avvale di una
lampada allo Xe che, adeguatamente filtrata, produce un emissione nell'intervallo 300-400
nm. Con un singolo flash è possibile ottenere ATP in concentrazioni fino a 1 mM da caged
ATP 2 mM.
Da un confronto tra laser e lampade si nota immediatamente la capacità dei laser di
produrre impulsi con energie sufficienti in tempi molto più brevi. A questo proposito il
vantaggio teorico di una maggior sincronizzazione è da valutarsi in relazione ai tempi
degli eventi successivi all'assorbimento dell'energia luminosa. Il raggio emesso dai laser
risulta inoltre più facile da orientare, modellare e focalizzare. La monocromaticità dei
laser, pur diminuendone la versatilità, costituisce un vantaggio in quanto evita la
dissipazione di energia in zone dello spettro non utili e sotto certi aspetti
indesiderate. Nettamente a sfavore degli apparati laser sono i costi sia d'acquisto, fino
a 10 volte superiori a quelli di una lampada, sia di mantenimento.
1.4 Reazioni fotolitiche e loro prodotti
Il primo evento di una reazione fotochimica è l'assorbimento di un
quanto di luce da parte di una molecola con passaggio di un elettrone dall'orbitale in cui
si trovava ad uno ad energia superiore. Gli stati eccitati che possono così venirsi a
creare (stati di singoletto S1,S2 ... nel caso sia mantenuta la molteplicità di spin
elettronico, e stati di tripletto T1, T2, ... in caso contrario) sono tra di loro e
rispetto allo stato fondamentale S0, specie con differenti strutture e reattività. La
molecola eccitata si trova, in ogni caso, in una condizione di minor stabilità rispetto
allo stato fondamentale corrispondente e possiede perciò una tendenza intrinseca sia a
liberare nuovamente l'eccesso di energia, sia ad utilizzarlo in reazioni chimiche.
La reazione fotochimica di un caged compound dà tipicamente origine all'effettore libero,
quindi attivo, e ad un sottoprodotto generalmente affine al gruppo di protezione. Questo
avviene, di norma, per rottura del legame che unisce l'effettore alla restante parte della
molecola, in una reazione le cui caratteristiche dipendono principalmente dal gruppo di
protezione.
Per i derivati o-nitrobenzilici la reazione di base è una ossido-riduzione interna
fotoindotta, caratteristica di tutti i sistemi aromatici contenenti un gruppo nitro in
orto ad un carbonio benzilico legato ad almeno un idrogeno. Come risultato si ha la
riduzione del nitro gruppo a nitroso e l'inserzione di un ossigeno sul carbonio a. In assenza di un gruppo uscente sul carbonio benzilico si ha
l'addizione di un OH; è questo ad esempio il caso della reazione della o-nitrobenzaldeide
ad acido o-nitrosobenzoico:
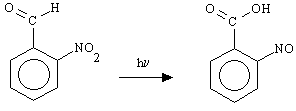
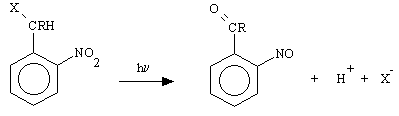
Nel caso sia invece presente un gruppo uscente, che per i caged compounds in genere costituisce l'effettore, si ha la rottura del legame tra questo ed il carbonio benzilico che forma così un doppio legame con l'ossigeno dando origine come sottoprodotto ad una o-nitrosobenzaldeide o ad un o-nitrosobenzochetone:
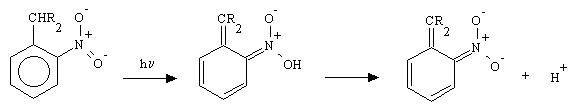
Il primo passaggio della reazione è l'estrazione di un idrogeno dal carbonio benzilico ad opera del NO2 seguito da un processo di ridistribuzione elettronica che porta alla formazione di un intermedio aci-nitro [11]. Questo ha carattere decisamente acido, (pKa=3.7 per la forma aci-nitro del toluene) per cui a pH vicini alla neutralità si presenta essenzialmente in forma di anione. La forma neutra in acqua non sembra essere rilevabile, probabilmente perché ha un tempo di vita troppo breve; per la comparsa dell'intermedio ionico e del protone k > 105 s-1.
Lo spettro di assorbimento dello ione aci-nitro presenta un picco poco al di sopra dei 400 nm, (406 nm per quello derivante dalla fotolisi di caged ATP), lunghezza d'onda alla quale il caged di partenza ha in genere un basso coefficiente di estinzione molare. Rilevando l'assorbimento del campione a questa
l è quindi possibile seguire la comparsa ed il successivo decadimento dell'intermedio. Tale passaggio è stato sperimentalmente individuato nella fotolisi di composti diversi come caged nucleotidi [98] e caged carbamilcolina [60, 96].La coincidenza delle cinetiche dei primi tre eventi, rilevata
sperimentalmente, indica una concomitanza tra decadimento dello ione aci-nitro e comparsa
dei prodotti e quindi l'assenza di ulteriori intermedi a lunga vita. Questa ipotesi è
ulteriormente confermata dalle variazioni della concentrazione di H+. A pH 6.5
il complesso MgATP (pKa=4) è completamente deprotonato, mentre l'ATP (pKa=6.5)
è parzialmente protonato. Quando nel campione è presente Mg++ la
concentrazione di H+, dopo il rapido aumento iniziale contemporaneo alla
formazione dello ione aci-nitro, non subisce ulteriori variazioni; in assenza di Mg++
invece si registra un aumento di pH, dovuto alla protonazione dell'ATP rilasciato, ad una
velocità uguale a quella di decadimento dell'intermedio.
Sono state portate evidenze sperimentali della contemporaneità tra formazione dei
prodotti e scomparsa dello ione aci-nitro anche per caged carbamilcolina [96], ed un
analogo comportamento è stato proposto per caged InsP3 [95] e DM-nitrofen
[46]. L'esatto meccanismo di questo secondo passaggio può presentare però delle
differenze, come indicano le diverse velocità e la diversa dipendenza dal pH del
decadimento dell'intermedio nel caso di gruppi uscenti diversi.
In sintesi per i derivati o-nitrobenzilici la reazione fotolitica può essere
schematicamente scritta nella forma:
![]()
Il sottoprodotto di questa reazione, generalmente 2-nitrosoacetofenone, tende a reagire con i gruppi SH delle proteine; inoltre essendo insolubile in acqua può determinare un intorbidimento del campione ed interferire con analisi di tipo spettroscopico. Questi effetti possono essere neutralizzati aggiungendo tioli idrofilici come ditiotreitolo (DTT) o glutatione (GSH) che competono con i gruppi SH proteici e formano con il nitrosocomposto un addotto solubile i cui coefficienti di estinzione molare sono
e380=850 M-1cm-1, e347@660 M-1cm-1.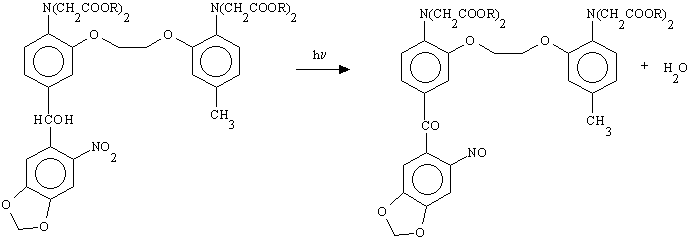
Nel caso del DM-nitrofen, invece, la variazione è di tipo strutturale; la reazione fotolitica determina la spaccatura dell'EDTA in due porzioni diacetiche la cui affinità per il calcio è praticamente nulla.
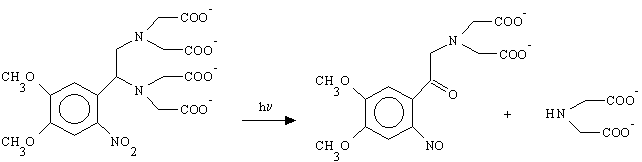
La fotolisi di derivati benzoinici dà come sottoprodotto un fenilbenzofurano che si genera in seguito alla formazione di un legame tra l'ossigeno benzoinico e la posizione 2 o 6 dell'anello benzenico non coniugato.
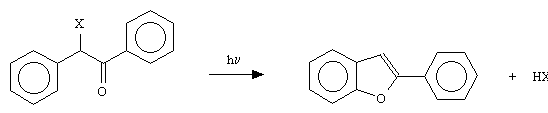
Il fenilbenzofurano dovrebbe essere essenzialmente inerte nei confronti
dei sistemi biologici. Il suo spettro di assorbimento ha un picco a circa 310 nm e scende
poi rapidamente per portarsi a valori abbastanza bassi a 350 nm [82].
I derivati 3,5-dinitrofenilici reagiscono con una molecola d'acqua formando come
sottoprodotto 3,5-dinitrofenolo. Per il DNP-caged Pi la reazione è:
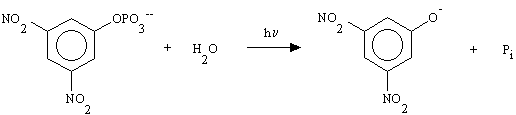
Il 3,5-dinitrofenolo non mostra particolare reattività nei confronti di sistemi biologici, ma il suo assorbimento, che si estende fino al visibile e ha un picco a 400 nm (
e=2800 M-1cm-1), è ancora abbastanza alto a l tali da poter interferire nella fotolisi del caged quando venga usata una lampada a flash allo Xe [15].1.5 Velocità e rese fotolitiche
La velocità alla quale l'effettore viene rilasciato e la quantità
dello stesso liberata come conseguenza di un singolo flash sono due caratteristiche
cruciali per un caged compound. In Tabella 1 vengono riportati i valori delle costanti di
velocità (k) e delle rese quantiche (Qp) per diversi di questi
composti.
La velocità di formazione dei prodotti fotolitici può essere determinata seguendo
spettrofotometricamente a 406 nm il decadimento dell'intermedio aci-nitro, almeno in quei
casi in cui i due eventi sono, come visto precedentemente, concomitanti.
In alternativa si può analizzare la comparsa del nitrosocomposto registrando
l'assorbimento a 740 nm oppure sfruttando la sua reazione con i tioli [57] e la
conseguente comparsa della banda di assorbimento a 380 nm. Quest'ultima modalità
operativa è efficace quando la reazione tra i tioli e il nitrosocomposto non costituisca
il passaggio determinante la velocità di formazione dell'addotto finale. Nel caso del
2-nitrosoacetofenone tale velocità diventa indipendente dai tioli per concentrazioni di
questi > 1 M e la reazione vicino alla neutralità ha una dipendenza del
primo ordine dalla [OH-] con una costante k = 4.5 x 108 M-1s-1.
In queste condizioni i limiti entro i quali può essere valutata la velocità di fotolisi
sono di 45 s-1 a pH 7 e 450 s-1 a pH 8. Per il
3,4-dimetossi-6-nitrosoacetofenone invece, per il quale la reazione rimane dipendente dai
tioli, a concentrazione 1 M di questi ultimi i valori limite sono 350 s-1
a pH 7 e 3500 s-1 a pH 8.
Composto |
k (s-1) a |
Qp |
|
|---|---|---|---|
1-(2-nitrofenil)etil fosfato |
8 x 104 |
0.54 |
[98] |
1-(2-nitrofenil)etil ATP |
86 b |
0.63 |
[98] |
1-(2-nitrofenil)etil ATP analoghi |
35 - 250 b |
0.49 - 0.57 |
[98] |
1-(2-nitrofenil)etil GTP analoghi |
70 - 230 |
0.35 - 0.6 |
[21] |
1-(2-nitrofenil)etil InsP3 |
175 - 280 c |
0.65 |
[95] |
4,5-dimetossi-2-nitrobenzil cGMP |
>8500 |
0.01 |
[50, 57] |
N-(2-nitrobenzil) carbamilcolina |
410 |
0.2 - 0.3 |
[96] |
N-(1-(2-nitrofenil)etil) carbamilcolina |
104 |
0.2 - 0.3 |
[60, 96] |
N-( a-carbossi-2-nitrobenzil) carbamilcolina |
1.7 x 104 |
0.8 |
[60] |
N-(1-(2-nitrofenil)etilossicarbonil) serina |
17 |
0.7 |
[51] |
1-(2-nitrofenil)etil fenilefrina |
3 |
0.4 |
[94] |
| acido 4-formil-6-metossi-3-nitrofenossiacetico d | >6 x 105 |
0.18 |
[45] |
2-idrossifenil-1-(2-nitrofenil)etil fosfato d |
>600 |
0.4 |
[56] |
Una terza possibilità è poi quella di determinare la velocità di
comparsa dell'effettore con metodi specifici. Per i caged Ca++ si utilizzano
indicatori per il Ca++ come l'antipirilazo III [47], per i caged protoni
indicatori di pH come il rosso fenolo [45]. Per alcuni effettori si possono utilizzare
test biologici come la dissociazione dell'actomiosina per l'ATP [58], variazioni di
corrente di membrana per il Ca++ [33], risposta di canali ionici per cGMP [50].
Dai dati ottenuti per i vari caged compounds è risultato che la velocità della reazione
fotolitica dipende, oltre che dal tipo di effettore, da caratteristiche proprie del gruppo
protettore e da fattori quali pH, forza ionica, temperatura.
La presenza di sostituenti sul carbonio benzilico (generalmente CH3) determina
un miglioramento della velocità di fotolisi sia per il caged ATP che per la
carbamilcolina; in quest'ultimo caso poi, il gruppo carbossile appare più efficace di
quello metilico. Anche la presenza di gruppi metossi nelle posizioni 4 e 5 dell'anello
benzenico sembra favorire la reazione. Questa variante è generalmente impiegata per caged
cGMP e caged cAMP le cui corrispondenti forme non sostituite hanno velocità circa 200
volte inferiore [71].
Un fattore che influenza fortemente la velocità di rilascio dell'effettore è il pH
(Figura 1). Tutti gli esteri fosforici mostrano una dipendenza del primo ordine dalla [H+]
nell'intervallo di pH 6-9; a pH superiori la reazione diventa indipendente. Andamento
diverso si ha per la caged carbamilcolina ed in particolare per il derivato
1-(2-nitrofenil)etilico, in cui il gruppo protettore è lo stesso del caged ATP, che
mostra un minimo a pH 9 ed un netto aumento a valori più alti. E` questo un chiaro indice
del fatto che il decadimento dell'intermedio aci-nitro, determinante la velocità di
entrambe le reazioni, avviene secondo meccanismi diversi nei due casi.
|
Studi effettuati con il caged ATP hanno evidenziato la dipendenza della
reazione fotolitica dalla temperatura e dalla forza ionica del mezzo (I); per quest'ultimo
fattore è stata ricavata empiricamente la relazione log k = 1.67 - 0.445 log
I [57]. L'influenza della [Mg++] sembra essere caratteristica di caged ATP e
analoghi in quanto non si manifesta per caged Pi, ADP, InsP3.
L'efficienza del processo fotolitico dipende, per quanto riguarda il composto, dalla sua
capacità di assorbire luce, cioè dal suo coefficiente di estinzione molare (e) alla lunghezza d'onda della luce utilizzata, e dalla sua
resa quantica (Qp). Quest'ultima è definita come il numero di molecole di
prodotto formate per quanto di luce assorbito. La definizione del Qp è un
processo complesso per la difficoltà nella valutazione dell'energia luminosa
effettivamente assorbita dal composto in questione. La determinazione diretta di questo
valore è stata effettuata per molti composti, come caged carbamilcolina, caged Pi,
caged Ca++, e con diversi metodi [1, 49, 60, 94]. In alternativa si può
ottenere il Qp per confronto con un caged compound a Qp noto,
illuminando un campione che contenga entrambi i composti e rapportando le quantità di
effettori ottenute [15, 95, 97]. In Tabella 1 sono riportati alcuni dei valori
determinati.
Da studi condotti inizialmente sull'ATP, il Qp per gli esteri fosforici
risultava incrementato dalla presenza di un sostituente metilico sul carbonio a. Costituiva una eccezione il fosfato per il quale
l'efficienza fotolitica era analoga per le due forme. Nel caso della carbamilcolina è
invece l'aggiunta di un gruppo carbossilico a migliorare il rendimento del caged. E'
quindi difficile fare considerazioni generali sulle caratteristiche di un ideale gruppo di
protezione, anche per la carenza di studi sistematici in questo senso. Un interessante
lavoro svolto con caged ammine dimostra però che sostituenti presenti sul carbonio
benzilico e sull'anello benzenico influenzano fortemente i valori di Qp [11].
La percentuale di fotolisi ottenuta con un singolo flash dipende però da diversi altri
fattori quali la durata e l'intensità dell'impulso luminoso, la geometria del campione e
la concentrazione del caged compound. I valori ottenuti possono essere inferiori od anche
superiori a quelli attesi in base al Qp. Ai fini pratici risulta quindi
necessario determinare sperimentalmente l'efficienza fotolitica nelle condizioni usate. La
quantità di effettore rilasciata può essere valutata analiticamente oppure
dall'intensità dell'assorbimento dell'intermedio aci-nitro. All'interno di un definito
protocollo sperimentale le quantità di prodotto dipendono dalla concentrazione iniziale
del caged e dall'intensità dell'impulso luminoso. Come riferimento si consideri che con
un singolo lampo sono state ottenute variazioni di ATP fino a 5 mM a partire da
concentrazioni di caged ATP 10 mM e utilizzando 1-(2-nitrofenil)etil fosfato 5 mM il salto
di concentrazione del Pi arriva a 1.5 mM. Variazioni inferiori, dell'ordine di
10 mM, sono state ottenute per i nucleotidi
ciclici, sia per il loro basso Qp, sia per le minori concentrazioni iniziali di
caged (~100 mM) dovute alla loro bassa
solubilità. Con i caged H+ si possono produrre salti di pH di circa 1 unità a
partire da 1 mM di 2-idrossifenil-1-(2-nitrofenil)etil fosfato [52] o 300 mM di acido 4-formil-6-metossi-3-nitrofenossiacetico [45].
Per i caged Ca++ i parametri di velocità e resa sono da considerarsi riferiti
non tanto alla reazione fotolitica in quanto tale, ma piuttosto al rilascio del calcio.
Sia per la serie dei nitr che per il DM-nitrofen la cinetica della fotolisi può essere
seguita spettrofotometricamente grazie alle differenze di assorbimento del caged prima e
dopo il flash [1], o seguendo il decadimento dell'intermedio aci-nitro [47]. I risultati
così ottenuti, confrontati con misurazioni cinetiche del rilascio del calcio effettuate
con indicatori specifici, mostrano che non vi sono differenze tra le velocità dei due
processi. Le quantità di calcio rilasciate dipendono in modo drastico dalla differenza
tra le costanti di dissociazione del chelante prima e dopo la fotolisi. Nella Tabella 2
vengono riportate queste ed altre caratteristiche per il DM-nitrofen e per il nitr-5, uno
dei più interessanti elementi della serie nitr [1, 47].
| Caged | KdCa(M) |
Kd'Ca(M) |
Kd'/Kd |
QpCa |
kCa (s-1) |
KdMg(M) |
Kd'Mg(M) |
Kd'/Kd |
|---|---|---|---|---|---|---|---|---|
| Nitr-5 | 1.5 x 10-7 |
6.3 x 10-6 |
40 |
0.04 |
3000 |
8.5 x 10-3 |
8.0 x 10-3 |
1 |
| DM-nitrofen | 5.0 x 10-9 |
3.0 x 10-3 |
105 |
0.18 |
~5000 |
2.5 x 10-6 |
3.0 x 10-3 |
103 |
Una importante caratteristica per i caged Ca++ è
discriminare tra Ca++ e altri cationi, in particolare Mg++; in
questo il nitr-5 risulta nettamente superiore al DM-nitrofen. D'altra parte la minor
selettività del DM-nitrofen lo rende utilizzabile anche come caged Mg++.
Altra differenza evidente è la variazione della costante di dissociazione tra prima e
dopo la fotolisi; il valore drasticamente più alto per il DM-nitrofen comporta che con
questo si possano ottenere aumenti nella concentrazione del calcio fino a 50-100 mM, mentre per il nitr-5 tali valori sono inferiori a 10 mM.
I derivati benzoinici presentano elevatissime velocità di fotolisi. Il tentativo di
determinarla con un time resolved spettrometro seguendo l'aumento dell'assorbimento a ~315
nm, dovuto alla comparsa del fenilbenzofurano, ha portato a concludere che tale velocità
deve essere > 105 s-1 in quanto supera i limiti di risoluzione
temporale dello strumento [14]. Da calcoli di tipo meccanicistico effettuati per degli
esteri fosforici del benzoino sembra si raggiungano anche valori di 108 s-1
[27]. Anche se dati precisi in merito sono ancora scarsi, l'efficienza fotolitica appare
buona e sembra essere migliorata dalla presenza di gruppi metossi nelle posizioni 3' e 5'
sia per esteri fosforici che carbossilici [82]; per il dimetossibenzoin fosfato (DMB caged
Pi) è riportato un Qp=0.78 [14]. Le quantità di effettore che si
ottengono con un singolo flash sono comunque limitate [91] probabilmente a causa del basso
assorbimento di questi composti alle l efficaci
per la fotolisi: e347=170 M-1cm-1. L'uso di
luce ad una lunghezza d'onda di 320 nm, alla quale aumenta l'assorbimento del composto (e320=620 M-1cm-1), risulta però anche meno efficiente; in
questo caso diminuiscono probabilmente le transizioni utili per la lisi del caged.
Il 3,5-dinitrofenile sembra essere un buon gruppo di protezione per il Pi che
viene rilasciato rapidamente (k>104 s-1) e con buone rese (Qp=0.67),
ma non per composti come l'ATP con il quale la fotosensibilità risulta inferiore di
almeno cento volte [15].